

 Ru | En
Ru | En



 Ru | En
Ru | En

 Сегодня, когда заходит речь о стволовых клетках, у многих возникают ассоциации прежде всего с коммерческой медициной, «чудесным» омоложением и рисками, с этим связанными. Между тем исследования стволовых клеток — один из самых перспективных разделов регенеративной клеточной медицины, сулящий людям излечение от многих тяжелых болезней: цирроза печени, инсульта, паралича, диабета, эпилепсии. Неслучайно в 1999 году журнал «Science» признал открытие стволовых клеток третьим по значимости событием в биологии после расшифровки двойной спирали ДНК и программы «Геном человека».
Сегодня, когда заходит речь о стволовых клетках, у многих возникают ассоциации прежде всего с коммерческой медициной, «чудесным» омоложением и рисками, с этим связанными. Между тем исследования стволовых клеток — один из самых перспективных разделов регенеративной клеточной медицины, сулящий людям излечение от многих тяжелых болезней: цирроза печени, инсульта, паралича, диабета, эпилепсии. Неслучайно в 1999 году журнал «Science» признал открытие стволовых клеток третьим по значимости событием в биологии после расшифровки двойной спирали ДНК и программы «Геном человека».
В России этот метод лечения внедряется с 1986 года. «Стволовые» методики используются в Институте биологической медицины, в Научном центре сердечнососудистой хирургии им. А.Н. Бакулева, в ФНЦ трансплантологии и искусственных органов им. В.И. Шумакова, в НЦ акушерства, гинекологии и перинатологии им. В.И. Кулакова РАМН, в Российском научном онкологическом центре им. Н.Н. Блохина РАМН и других ведущих медицинских учреждениях.
Исследования в области стволовых клеток идут и в Екатеринбурге, в Институте иммунологии и физиологии УрО РАН и в Институте медицинских клеточных технологий под руководством доктора медицинских наук, зав. лабораторией иммунофизиологии и иммунофармакологии ИИФ Бориса Юшкова. Правда, Борис Германович обозначил сразу, что он и его сотрудники занимаются чисто фундаментальными проблемами, поэтому наш разговор начался с краткого экскурса в историю и теорию вопроса.
— Термин «стволовая клетка» был впервые введен в научную литературу выдающимся немецким биологом Эрнстом Хекелем в 1868 году. Существенный вклад в теорию стволовых клеток в начале XX века внесли русские ученые Вера Данчакова и Александр Максимов. В 1957 году будущий лауреат Нобелевской премии Эдвард Томас опубликовал работу, в которой впервые была описана пересадка костного мозга больному лейкемией. Первая в мире трансплантация стволовых клеток пуповинной крови ребенку была проведена Элиан Глюкман в 1988 году в парижской клинике Святого Людвига. В 1998 американским ученым Джеймсу Томсону и Джону Беккеру удалось выделить человеческие эмбриональные стволовые клетки и получить первые линии таких клеток.
Стволовая клетка — родоначальница всех клеток организма, способная к самообновлению и развитию в специализированные клетки — мышечные, печеночные, кожные, нервные. 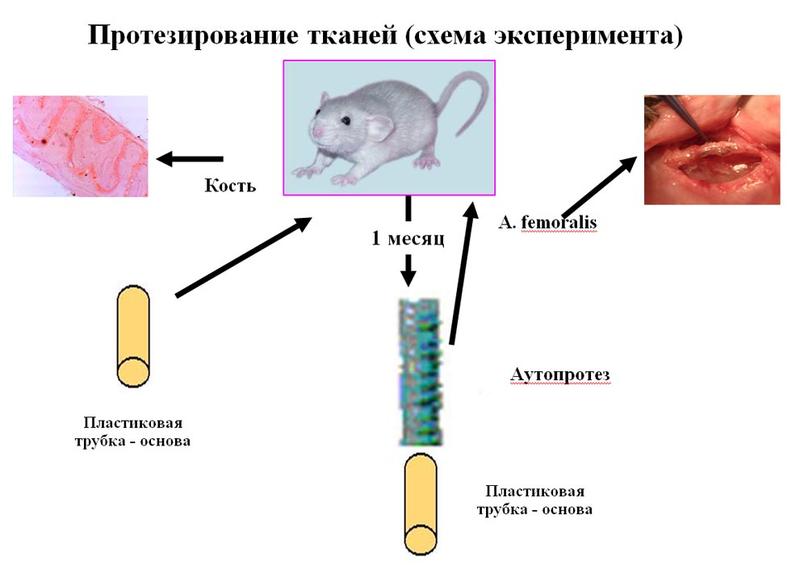 Есть ключевой вопрос биологии, который часто упускают в дискуссиях о стволовых клетках: может ли отдельная клетка и ее потомки существовать дольше, чем организм в целом. Как известно, для клеток существует лимит Хейфлика, который ограничивает количество делений. Для соматических клеток — фибропластов — это приблизительно 50 делений, т.е. клетка не может пережить организм. Но тогда убыль клеток должна как-то компенсироваться, должен существовать механизм, благодаря которому клетки восполняются. В качестве такого механизма работают стволовые клетки, обладающие тремя свойствами. Прежде всего, они способны достаточно долго воспроизводить в процессе деления самих себя, причем в точности. Это свойство стволовой клетки получило название самоподдержания. Другое важнейшее свойство — потенциальная способность дифференцироваться, развиваться в любую клетку организма, или свойство полипотентности. И третье — стволовые клетки каким-то образом контролируют свое общее количество в организме в целом и в отдельных тканях.
Есть ключевой вопрос биологии, который часто упускают в дискуссиях о стволовых клетках: может ли отдельная клетка и ее потомки существовать дольше, чем организм в целом. Как известно, для клеток существует лимит Хейфлика, который ограничивает количество делений. Для соматических клеток — фибропластов — это приблизительно 50 делений, т.е. клетка не может пережить организм. Но тогда убыль клеток должна как-то компенсироваться, должен существовать механизм, благодаря которому клетки восполняются. В качестве такого механизма работают стволовые клетки, обладающие тремя свойствами. Прежде всего, они способны достаточно долго воспроизводить в процессе деления самих себя, причем в точности. Это свойство стволовой клетки получило название самоподдержания. Другое важнейшее свойство — потенциальная способность дифференцироваться, развиваться в любую клетку организма, или свойство полипотентности. И третье — стволовые клетки каким-то образом контролируют свое общее количество в организме в целом и в отдельных тканях.
Потери клеток, происходящие по самым разным причинам — в результате травматического повреждения, радиационного облучения, воспалительного процесса, — сначала восполняются за счет деления и дифференцировки стволовых клеток, находящихся в самом поврежденном органе. Однако их запас в тканях взрослого организма ограничен. Если их не хватает для восстановления функции органа или ткани, «на помощь спешат» другие стволовые клетки. Их поставляет костный мозг, оттуда они с кровотоком поступают к поврежденному органу, где под влиянием различных сигнальных веществ превращаются в специализированные клетки, которые замещают погибшие.
Чудес не бывает Нередко обновить утраченные клетки организм самостоятельно уже не в состоянии: или очаг поражения слишком велик, или организм ослаблен, или возраст немолодой. Если у новорожденного одна стволовая клетка приходится на 10 тысяч кроветворных клеток, то к 20–25 годам — одна на 100 тысяч, к 50 — на 500 тысяч, а к 80 годам — одна на 5–8 миллионов. Согласно одной из теорий, процесс старения как раз и связан с истощением их запаса. Стареющему организму можно помочь — ввести ему порцию стволовых клеток, взятых от молодого, и получить омолаживающий или лечебный эффект. Однако чудес не бывает. Немало знаменитостей, прошедших процедуру омоложения эмбриональными стволовыми клетками, получили совсем не тот результат, которого ожидали, — от ухудшения внешнего вида до развития онкологии. Спрашиваю у Бориса Германовича:
Нередко обновить утраченные клетки организм самостоятельно уже не в состоянии: или очаг поражения слишком велик, или организм ослаблен, или возраст немолодой. Если у новорожденного одна стволовая клетка приходится на 10 тысяч кроветворных клеток, то к 20–25 годам — одна на 100 тысяч, к 50 — на 500 тысяч, а к 80 годам — одна на 5–8 миллионов. Согласно одной из теорий, процесс старения как раз и связан с истощением их запаса. Стареющему организму можно помочь — ввести ему порцию стволовых клеток, взятых от молодого, и получить омолаживающий или лечебный эффект. Однако чудес не бывает. Немало знаменитостей, прошедших процедуру омоложения эмбриональными стволовыми клетками, получили совсем не тот результат, которого ожидали, — от ухудшения внешнего вида до развития онкологии. Спрашиваю у Бориса Германовича:
— В чем минусы использования чужеродных стволовых клеток?
— Во-первых, это связано с этическими проблемами, ведь основной источник эмбриональных стволовых клеток — материал, остающийся после абортов, а также пуповина и плацента новорожденного ребенка. Далее, когда донорские клетки получены, их надо очистить, накопить и хранить. В процессе хранения уменьшается количество пригодных к использованию стволовых клеток: снижаются их цитохимические показатели, и происходит внутриклеточная перестройка метаболизма. А данные об их изменениях в ходе десятилетнего хранения на сегодняшний день противоречивы. К тому же, размножаясь в культуре, стволовые клетки расходуют лимит деления.
Еще одна серьезная проблема — чужеродные стволовые клетки могут отторгаться организмом. Конечно, можно брать клетки пуповинной крови самого человека при рождении и замораживать, чтобы в случае необходимости разморозить и использовать. И это делается в мире. Стволовые клетки содержатся в культуре, их можно размножать и вызывать превращение в специализированные клетки, а затем пересаживать больному взамен погибших. Но создание индивидуальных банков пуповинной крови в массовом порядке — дело дорогое, и вряд ли это возможно в близком будущем.
Помоги себе сам
Уральские иммунофизиологи считают, что самое перспективное направление — активация собственных стволовых клеток организма. Они не отторгаются, вероятность их злокачественного перерождения минимальна, и этических проблем в этом случае не возникает.
— Как «поторопить» стволовые клетки к месту аварии в организме и сделать так, чтобы они выстроили здоровую ткань?
— Чтобы стимулировать миграцию собственных клеток организма в поврежденный орган, нужно прежде всего вызвать определенные изменения в костном мозге, в результате которых стволовая клетка покинет свою «нишу» и приобретет способность к миграции, размножению и дифференцировке. Для этого разрабатываются специальные препараты. Затем надо задать так называемый «маяк» миграции; и, наконец, необходимо направлять процесс дифференцировки стволовых клеток в поврежденной ткани. Его определяют физические факторы, влияющие на форму клетки, цитокины — пептидные информационные молекулы и микроокружение. В печени стволовые клетки дифференцируются одним образом, в мышечной ткани — другим. Через микросреду, через изменение микроокружения мы учимся влиять на направление дифференцировки стволовых клеток. А если этот процесс пустить на самотек, то одни клетки превратятся в такие же, как те, что повреждены, и станут их восполнять, а другие могут «взбеситься» и начать размножаться, образуя опухоль.
То, что происходит со стволовыми клетками, — как они выходят из костного мозга, какой концентрации достигают в крови и в поврежденной ткани, — мы отслеживаем с помощью маркеров и применяем различные приемы, чтобы больше стволовых клеток попало в поврежденный участок. На сегодняшний день четкое морфологические описание стволовой клетки отсутствует. Чтобы ее идентифицировать, нужно искать дополнительные маркеры, чем мы и занимаемся.
Еще одна перспективная технология — конструирование стволовой клетки. Для этого ядро эмбриональной клетки вводится в зрелую клетку, и она приобретает свойства стволовой. Мы в этом направлении тоже продвигаемся, в нашей лаборатории есть необходимое оборудование и квалифицированные специалисты.
Есть у нас наработки в области лечения заболеваний нервной системы, в частности эпилепсии, а также сахарного диабета, ведь стволовые клетки под влиянием определенных факторов способны превращаться даже в нейроны и в бета-клетки, продуцирующие инсулин.
Альтернатива трансплантации
При всех успехах трансплантологии в этой отрасли медицины по-прежнему множество проблем: это и возможная биологическая несовместимость тканей, и те же этические проблемы с подбором донора. Ведь когда мы берем почку у донора, то остаются два инвалида — каждый с одной почкой. Поэтому сейчас бурно развивается другое направление — выращивание органов из стволовых клеток в культуре, в «пробирке». Каркас, созданный из соединительной ткани старого органа, заселяется стволовыми клетками, и образуется новый орган. В августе прошлого года американским биологам удалось вырастить искусственное сердце из перепрограммированных человеческих стволовых клеток, а в качестве каркаса они использовали соединительную ткань мышиного сердца. Этот рукотворный миокард сокращается, хотя и несколько хуже, чем сердце здорового человека. Есть также сообщения об удачном выращивании трахеи и легкого.
— Вы разрабатываете иную технологию создания «запчастей»?
— Мы выращиваем необходимые «детали» не в пробирке, а внутри самого живого организма, которому требуется замена больного органа, — говорит Борис Германович. — Вот как делается, к примеру, сосуд. Вшиваем пластиковую трубочку нужного размера под кожу крысы, там, естественно, развивается воспаление, и трубочка обрастает соединительной тканью. Затем инородное тело, т.е. пластиковую трубочку, извлекаем, и у нас остается соединительно-тканный каркас из собственных клеток организма — аутопротез. Его можно использовать не только как полноценный сосуд, но и как пластинку, если разрезать пополам. Такой пластинкой можно закрыть отверстие в кости, полученное в результате травмы, а можно сшить из нее мочевой пузырь. Подобные эксперименты мы проводили не только на крысах, но и на собаках и даже на свиньях. Выращивали таким образом кости у крысы и кролика. Причем после операций животное проживало свой обычный срок. Есть у этой методики один минус — фактор времени. Так, аутопротезирование бедренной артерии кролика заняло у нас 6 месяцев, черепно-мозговой кости крысы — 7. Если у человека случился инфаркт или он сломал ногу, некогда выращивать аутопротез. Но и плюсы очевидны: не нужны доноры, и органы, выращенные из собственной ткани, легко приживаются в организме. А это значит, что метод перспективен для лечения хронических патологий.
Фундаментальные исследования идут своим чередом, являя нам иногда настоящие чудеса, но медицинское применение пионерских клеточных технологий в нашей стране по-прежнему ограничено. И сдерживает его прежде всего отсутствие правовой базы. Еще в 2009 году правительство РФ поручило Минздравосцразвития, Минпромторгу и Минобрнауки разработать и представить на рассмотрение в Госдуму РФ проект закона «О применении биомедицинских технологий в медицинской практике». Однако законопроект вызвал неоднозначную реакцию общественности, религиозных деятелей и был отправлен на доработку. Федеральная служба по надзору в сфере здравоохранения и социального развития выдает отдельные разрешения на лечение собственными и донорскими стволовыми клетками ряда патологий. А закон, призванный в целом регламентировать сферу биомедицинских технологий, так и «завис» в Госдуме.
Е. ПОНИЗОВКИНА
Портрет Б.Г. Юшкова работы Сергея Новикова
|
620049, г. Екатеринбург, ул. Первомайская, 91 document@prm.uran.ru +7(343) 374-07-47 |