

 Ru | En
Ru | En



 Ru | En
Ru | En

 Коллекция микробных культур Института клеточного и внутриклеточного симбиоза Оренбургского НЦ УрО РАН была создана совсем недавно, в 2014 году, но уже получила первое место на форуме «Инновационное образование — локомотив технологического прорыва России» и XII ярмарке стартовых инновационных проектов и компаний «Российским инновациям — российский капитал» (Нижний Новгород, 2014). В отличие от микробных «моноколлекций» в оренбургском банке микроорганизмов представлены разнообразные культуры — штаммы нормальной микрофлоры человека и потенциально патогенные клинические изоляты, водные микроорганизмы и бактерии-нефтедеструкторы, а также индикаторные культуры. Выйти на новый уровень фундаментальных исследований этого микробного разнообразия удалось во многом благодаря созданию в институте в том же 2014 году центра коллективного пользования научным оборудованием, и прежде всего появлению нового высокопроизводительного секвенатора, который открывает широкие возможности для анализа генома бактерий.
Коллекция микробных культур Института клеточного и внутриклеточного симбиоза Оренбургского НЦ УрО РАН была создана совсем недавно, в 2014 году, но уже получила первое место на форуме «Инновационное образование — локомотив технологического прорыва России» и XII ярмарке стартовых инновационных проектов и компаний «Российским инновациям — российский капитал» (Нижний Новгород, 2014). В отличие от микробных «моноколлекций» в оренбургском банке микроорганизмов представлены разнообразные культуры — штаммы нормальной микрофлоры человека и потенциально патогенные клинические изоляты, водные микроорганизмы и бактерии-нефтедеструкторы, а также индикаторные культуры. Выйти на новый уровень фундаментальных исследований этого микробного разнообразия удалось во многом благодаря созданию в институте в том же 2014 году центра коллективного пользования научным оборудованием, и прежде всего появлению нового высокопроизводительного секвенатора, который открывает широкие возможности для анализа генома бактерий.
Вот что сказал о значимости оренбургской коллекционной работы директор ИКВС доктор медицинских наук Сергей Викторович Черкасов:
— Наша коллекция позволяет сохранить обширный и разнообразный генетический материал микроорганизмов, который необходим для научных исследований — моделирования, генной инженерии, а также для экспертно-эпидемиологических работ. Надеемся, что в ближайшем будущем она станет востребованной предприятиями биотехнологического кластера. А фундаментальная новизна нашей коллекции — в том, что мы исследуем микроорганизмы с точки зрения межмикробного взаимодействия, их антагонистической или синергетической активности.
 На вес золота
На вес золота
Существенная часть собранной в ИКВС коллекции — представители нормальной микрофлоры человека. Таких коллекций в России немного, самая известная — в Московском НИИ эпидемиологии и микробиологии им. Г.Н. Габрического.
По словам зав. лабораторией дисбиозов кандидата медицинских наук А.В. Валышева, коллекционировать штаммы нормальной микрофлоры необходимо для создания биопрепаратов и для тестирования антимикробных соединений. Александр Владимирович сравнивает отбор полезных для человека микробных штаммов с добычей золота. Чтобы найти драгоценную песчинку, нужно перемыть кучи песка, а из тысяч микробных штаммов только один может стать основой для создания пробиотика — антибактериального препарата, действие которого основано на антагонизме микробов между собой. Некоторые представители нормальной микрофлоры способны эффективно противостоять патогенным бактериям либо напрямую, продуцируя антимикробные факторы — лактат, лизоцим, перекись водорода, различные бактериоцины (специфические белки, подавляющие жизнедеятельность клеток других штаммов того же вида или родственных видов бактерий), либо опосредованно, лишая болезнетворные бактерии персистентных свойств, т.е. способности к долгому выживанию в организме.
К таким «борцам» с патогенами относятся грамположительные бактерии: бифидобактерии, лактобациллы и энтерококки. Последние обладают выраженной антагонистической активностью в отношении болезнетворных бактерий, в частности они продуцируют вещества, убивающие листерии. Это возбудители весьма опасного инфекционного заболевания — листериоза, в последнее время получившего распространение в развитых странах. Благоприятные условия для размножения листерий создаются на крупных молочных предприятиях и в супермаркетах, они попадают в организм человека через расфасованную пищевую продукцию. Антагонистов листерий можно вводить в организм в качестве живых бактерий, а можно выделять из них бактериоцин и применять в виде биоконсервантов.
Коллекционирование штаммов таких микроорганизмов актуально и в плане импортозамещения. Сотрудники лаборатории дисбиозов сравнили выделенные ими микроорганизмы с широко известными штаммами, на основе которых производятся популярные импортные препараты, и пришли к выводу, что оренбургские пробиотики вполне могут составить конкуренцию зарубежным аналогам.
Сегодня коллекция нормальной микрофлоры, собранная в лаборатории дисбиозов ИКВС и насчитывающая около тысячи штаммов, хранится …в обычном холодильнике. Большим подспорьем для оренбургских микробиологов стало получение пятимиллионного гранта областной администрации, однако для создания адекватных условий хранения ценной коллекции этого недостаточно.
Лактобациллы — главные защитники от инфекции репродуктивного тракта женщины, где они в норме составляют доминантную, т.е. господствующую микрофлору. Согласно данным сотрудников лаборатории по изучению механизмов микробиоценозов человека во главе с доктором медицинских наук С.В. Черкасовым, как острые, так и хронические воспалительные гинекологические заболевания связаны с дефицитом доминантной микрофлоры, способной противостоять патогенным микроорганизмам. Препятствуя развитию восходящей инфекции половых путей, лактобациллы создают благоприятную для зачатия и развития беременности микроэкологическую обстановку. Для восстановления состояния микробиоценоза принято использовать пробиотики, содержащие культуры лактобацилл. Однако, по словам доктора медицинских наук Е.А. Кремлевой, набор таких препаратов невелик и подходят они далеко не всем, поскольку микрофлора каждого человека индивидуальна. Получается, каждому нужна «своя» лактобацилла, если же она таковой не является, клетки макроорганизма подавляют рост пробиотического штамма, восстановление микрофлоры не происходит, следовательно, лечебный эффект равен нулю. Есть женщины, организму которых не подходит ни один из известных пробиотических препаратов. Именно поэтому так важно иметь обширную коллекцию штаммов лактобацилл, позволяющую создавать разнообразные комбинации пробиотиков для их персонифицированного подбора. Сейчас в лаборатории по изучению механизмов формирования микробиоценозов человека из репродуктивного тракта здоровых женщин выделено уже 30 потенциально пробиотических штаммов, а разработанный оренбургскими микробиологами способ индивидуального подбора пробиотика запатентован и удостоен международных наград.
Наибольший интерес в коллекции, собранной в лаборатории механизмов и регуляции персистенции бактерий (заведующая — доктор биологических наук Ольга Львовна Карташова), представляют три штамма, которые депонированы в Государственной коллекции микроорганизмов нормальной микрофлоры МНИИИЭМ им. Г.Н. Габрического и находятся в процессе патентования.
Штамм энтерококка, выделенный из кишечника человека, интересен тем, что может эффективно снижать способность грибов рода кандида образовывать биопленки. Он может быть использован в качестве основы для создания пробиотика. Другой штамм энтерококка был выделен в процессе изучения микрофлоры кишечника животных. Он ценен высокой антагонистической активностью в отношении листерий и других патогенных энтерококков, вызывающих заболевания у сельскохозяйственных животных, и также может быть использован для создания пробиотического препарата.
Совместно с хирургами Оренбургской железнодорожной больницы сотрудники лаборатории выделили от пациента с трофической язвой нижних конечностей штамм стафилококка, который обладает высокой антилизоцимной активностью и может быть использован в качестве тест-культуры для отбора антибактериальных средств, эффективных в отношении персистирующих патогенных стафилококков.
В лаборатории также имеются коллекция стафилококков, выделенных со слизистой оболочки носа человека, и коллекция дрожжеподобных грибов рода кандида, выделенных из разных биотопов тела человека, свойства этих микроорганизмов изучены на фенотипическом и генетическом уровнях.
Водное микроцарство
В субколлекцию природных фототрофных и гетеротрофных микроорганизмов входят культуры зеленых одноклеточных водорослей, диатомовых водорослей и бактерий-нефтедеструкторов. По словам зав. лабораторией водной микробиологии ИКВС доктора медицинских наук Наталии Вячеславовны Немцевой, коллекционные микроводоросли интересны тем, что выделены из уникальных мест обитания, прежде всего из гиперсоленых озер — Соль-Илецких, а также из озера Эльтон, где они успешно выживают благодаря симбиотическим связям. Ценность зеленых водорослей — в высоком содержании витаминов, ненасыщенных жирных кислот, антибактериальных соединений, которые губительно действуют на патогенную микрофлору и не причиняют вреда нормальной.
Один из замечательных представителей водной коллекции — зеленая одноклеточная водоросль Дуналиелла солоноводная. Ее биомасса — богатейший источник бета-каротина, который используется в химико-фармацевтической, пищевой и биотехнологической промышленности. Вообще у дуналиеллы как основы биодобавок масса достоинств — она помогает усвоению витаминов и микроэлементов, активизирует и нормализует обмен веществ, выравнивает экологическую среду кишечника, способствует связыванию и выведению из организма ксенобиотиков, т.е. чуждых ему веществ. Обладая антиоксидантными свойствами, дуналиелла повышает выносливость организма, что актуально для жителей регионов с неблагоприятными экологическими условиями. В комбинации с зелеными водорослями можно использовать археи — древние микроорганизмы, также обитающие в водоемах с экстремальными условиями и имеющиеся в коллекции ИКВС.
Казалось бы, производители биодобавок должны стоять в очередь к микробиологам за культурами зеленых водорослей. Однако…
— Сегодня предприятия, производящие биодобавки, работают исключительно с зарубежными штаммами Дуналиеллы солоноводной — чилийскими, израильскими, австралийскими, — поясняет Наталия Вячеславовна. — Многие желали бы, да не могут использовать российское сырье, потому что организация собственного биотехнологического производства требует огромных затрат. 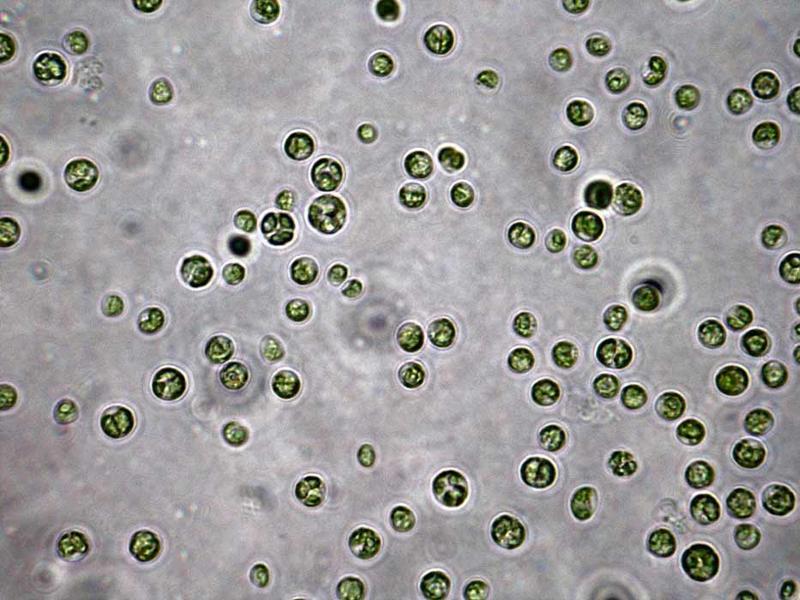 Еще один представитель коллекции одноклеточных зеленых водорослей — хлорелла, которую оренбургские микробиологи предлагают применять для очистки водоемов и сточной воды (на фото слева). Кстати, она «помогала» японцам ликвидировать радиоактивное загрязнение после аварии на Фукусиме.
Еще один представитель коллекции одноклеточных зеленых водорослей — хлорелла, которую оренбургские микробиологи предлагают применять для очистки водоемов и сточной воды (на фото слева). Кстати, она «помогала» японцам ликвидировать радиоактивное загрязнение после аварии на Фукусиме.
Свой вклад в «водную» коллекцию вносит группа кандидата медицинских наук А.О. Плотникова, который возглавляет институтский центр коллективного пользования. Его сотрудники исследуют биоразнообразие простейших в природных водоемах и симбиоз простейших с бактериями. Они подробно изучили гетеролобозных амебофлагеллятов — это редкие и эволюционно древние микроорганизмы. Их современные родственники неглерии вызывают воспаление оболочек головного мозга (менингоэнцефалит).
Собранные в коллекции ИКВС индикаторные культуры используются для проведения микробиологического мониторинга экологического и санитарно-гигиенического состояния оренбургских водоемов. Имеются в коллекции и родококки — деструкторы нефти и нефтепродуктов. Конечно, этих штаммов у оренбуржцев не так много, как у их пермских коллег (речь о Региональной профилированной коллекции алканотрофных микроорганизмов Института экологии и генетики микроорганизмов Пермского НЦ УрО РАН), однако коллекционировать их в Оренбурге, безусловно, стоит — ведь штамм, выделенный на территории Пермской области, может и не прижиться в южно-уральских водоемах.
Что же касается коммерциализации фундаментальных разработок, то серьезных «индустриальных партнеров», как теперь принято говорить, у оренбургских водных микробиологов пока нет. К сожалению.
Тесты на выживаемость
Значительная часть микробной коллекции ИКВС — так называемые клинические изоляты. Это потенциально болезнетворные микроорганизмы, в основном стафилококки и энтеробактерии, которые выделены не из природной среды, а из организма животных или людей, в том числе пациентов стационаров. На основе этих штаммов можно создавать микробные тест-системы, которые используются для диагностики инфекционно-воспалительных заболеваний, стандартизации лабораторных технологий, проведения доклинических испытаний новых лекарственных средств и мониторинга инфекций.
О том, как происходит отбор антибактериальных препаратов с помощью микробных тест-систем, рассказала зав. лабораторией биомониторинга и молекулярно-генетических исследований доктор медицинских наук Наталья Борисовна Перунова.
— Для того чтобы определить действенность того или иного лекарственного средства, используются тест-штаммы — это микроорганизмы, которые достаточно устойчивы к воздействию факторов защиты человека и потому способны к длительной персистенции, т.е. проживанию в организме. Такие свойства микроорганизмов (их персистенцию) можно использовать как биомишень. Если антибиотик (или гормональный препарат, или иммуномодулятор) оказывается эффективным против такого устойчивого персистентного штамма, значит, он тем более эффективен против других, менее устойчивых патогенных микроорганизмов.
Один из таких замечательных микроорганизмов, имеющих биомишень — клебсиелла, условно-патогенная энтеробактерия. Она способна очень долго находиться в организме и потому незаменима в качестве тест-штамма в ходе разработки и тестирования препаратов для борьбы с персистирующей инфекцией, в частности с хирургическими инфекциями мягких тканей. Так, в сотрудничестве со специалистами из Института органического синтеза УрО РАН оренбургские микробиологи создали новую мазь для лечения гнойных ран.
В лаборатории клеточного симбиоза во главе с доктором медицинских наук, профессором В.А. Гриценко коллекционируют возбудителей эндогенных бактериальных инфекций. Эта коллекция насчитывает уже около 500 штаммов. Ведь очень многие болезни — пиелонефрит, цистит, инфекции желчных путей, урогенитальные инфекции — вызывает собственная микрофлора организма.
Есть в лаборатории также коллекция культур возбудителей заболеваний перинатального периода (который начинается с 22–23-й недели беременности и завершается спустя неделю после рождения ребенка) — пневмонии, пиодермии, сепсиса. Еще одна группа — стафилококки, которые вызывают раневые инфекции у больных сахарным диабетом. Один из таких штаммов депонирован в Государственной коллекции нормальной микрофлоры МНИИИЭМ им. Г.Н. Габричевского.
Особая статья — возбудители разнообразных внутрибольничных инфекций. Сотрудники лаборатории клеточного симбиоза специализируются на изучении штаммов, вызывающих осложнения при хирургических вмешательствах, прежде всего гинекологических. Это серьезная проблема, поскольку такие осложнения возникают почти в четверти случаев. Клинические изоляты очень устойчивы к действию антибиотиков, поэтому применение традиционных антимикробных препаратов часто не дает результата. Тесно сотрудничая с клиницистами, ученые-микробиологи выделяют штаммы возбудителей практически у каждого больного. Накапливая их в коллекции, они могут создавать реестры бактерий для оценки эффективности разных антибиотиков — причем не эффективности вообще, а в отношении инфекций, циркулирующих в конкретном регионе и в конкретной больнице.  — Конечно, мы отбираем эталонные культуры, — говорит Виктор Александрович Гриценко, — однако нас интересуют также уникальные представители микрофлоры. Например, не просто кишечная палочка, а штамм с уникальным набором свойств персистенции. Это необходимо для того, чтобы ставить модельные эксперименты, вырабатывать новые технологии борьбы как с острыми, так и хроническими инфекциями.
— Конечно, мы отбираем эталонные культуры, — говорит Виктор Александрович Гриценко, — однако нас интересуют также уникальные представители микрофлоры. Например, не просто кишечная палочка, а штамм с уникальным набором свойств персистенции. Это необходимо для того, чтобы ставить модельные эксперименты, вырабатывать новые технологии борьбы как с острыми, так и хроническими инфекциями.
Коллекция лаборатории экологии микроорганизмов, которую возглавляет доктор медицинских наук С.Б. Фадеев, включает госпитальные и внебольничные штаммы энтеробактерий, стафилококков и других микроорганизмов, отличающихся по чувствительности к антибиотикам, набору факторов персистенции и патогенности.
— По данным исследований, которые мы проводим с 1990-х годов, существенно меняется спектр возбудителей внебольничных и госпитальных инфекций, — отмечает Сергей Борисович. — Так, например, повышается значение стафилококков, которые вызывают тяжелые некротические формы хирургической инфекции. Они плохо поддаются лечению, особенно у больных сахарным диабетом и у наркотически зависимых людей. Сотрудники лаборатории обследуют бактерионосителей, которые могут быть «разносчиками» подобных микроорганизмов. Штаммы нашей коллекции позволяют провести предварительную оценку эффективности антибиотиков и помочь практическому здравоохранению в регионе.
У антибиотиков есть один крупный недостаток: чем больше мы их потребляем, тем быстрее они становятся неэффективными. Серьезной проблемой ближайшего будущего могут стать бактерии, резистентные к карбапенемам. По данным Всемирной организации здравоохранения инфекции, вызванные резистентными возбудителями, ежегодно становятся причиной гибели 700 тысяч людей в мире. Согласно официальным прогнозам, при сохранении таких темпов распространения устойчивых «супербактерий» и отсутствии новых препаратов к середине XXI века эта цифра составит 10 миллионов, превысив смертность от онкологической патологии (8,2 миллионов в год). Сейчас предпринимаются меры для сдерживания роста устойчивости бактерий к антибиотикам. Однако альтернативу им искать все равно придется. Специалисты ИКВС, используя свои постоянно обновляющиеся коллекции, отбирают антимикробные субстанции растительного происхождения. При этом оценивается способность препарата не только нанести непосредственный «урон» бактериальной клетке (что может привести к развитию резистентности), но и ослабить или подавить защиту микроорганизмов. Такой вариант «мягкого» воздействия в итоге приводит к ликвидации возбудителя, предотвращая бактерионосительство. Сотрудники института помимо изучения микроорганизмов стандартными способами оценивают их свойства с позиций новых направлений современной инфектологии — микробной симбиологии и ассоциативного симбиоза. В перспективе это позволит создавать новые бактериальные препараты, влияющие как на клетки и ткани человека, так и на его микробиом.
Е. ПОНИЗОВКИНА
|
620049, г. Екатеринбург, ул. Первомайская, 91 document@prm.uran.ru +7(343) 374-07-47 |